问题:
已知:
①将煤转化为水煤气的主要化学反应为C(s)+H 2O(g)  CO(g)+H 2(g);
CO(g)+H 2(g);
②C(s)、CO(g)和H 2(g)完全燃烧的热化学方程式分别为:
C(s) +O 2(g)=CO 2(g) △H=-393.5 kJ/mol
CO(g) +l/2O 2(g)=CO 2(g) △H= -283.0 kJ/mol
H 2(g) +l/2O 2(g)=H 2O(g) △H= -242.0 kJ/mol
请回答:
(1)根据以上信息,写出C(s)与水蒸气反应的热化学方程式:________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H 2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的 热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图所示的循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
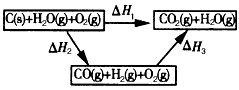 请分析:甲、乙两同学观点正确的是_____(填 “甲”或“乙”);判断的理由是_____________。将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点____________。
请分析:甲、乙两同学观点正确的是_____(填 “甲”或“乙”);判断的理由是_____________。将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点____________。
已知:
①将煤转化为水煤气的主要化学反应为C(s)+H 2O(g) CO(g)+H 2(g);
CO(g)+H 2(g);
②C(s)、CO(g)和H 2(g)完全燃烧的热化学方程式分别为:
C(s) +O 2(g)=CO 2(g) △H=-393.5 kJ/mol
CO(g) +l/2O 2(g)=CO 2(g) △H= -283.0 kJ/mol
H 2(g) +l/2O 2(g)=H 2O(g) △H= -242.0 kJ/mol
请回答:
(1)根据以上信息,写出C(s)与水蒸气反应的热化学方程式:________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H 2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的 热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图所示的循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
 请分析:甲、乙两同学观点正确的是_____(填 “甲”或“乙”);判断的理由是_____________。将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点____________。
请分析:甲、乙两同学观点正确的是_____(填 “甲”或“乙”);判断的理由是_____________。将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点____________。
①将煤转化为水煤气的主要化学反应为C(s)+H 2O(g)
 CO(g)+H 2(g);
CO(g)+H 2(g); ②C(s)、CO(g)和H 2(g)完全燃烧的热化学方程式分别为:
C(s) +O 2(g)=CO 2(g) △H=-393.5 kJ/mol
CO(g) +l/2O 2(g)=CO 2(g) △H= -283.0 kJ/mol
H 2(g) +l/2O 2(g)=H 2O(g) △H= -242.0 kJ/mol
请回答:
(1)根据以上信息,写出C(s)与水蒸气反应的热化学方程式:________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H 2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的 热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图所示的循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。

参考答案:
