问题:
某研究性学习小组用不纯的氧化铝(杂质为Fe 2O 3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
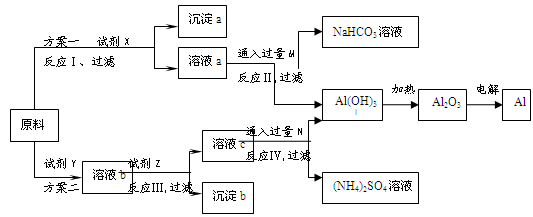
(1)试剂X的化学式为 ,反应Ⅰ的离子方程式是 。实验室配制480mL 1 mol·L -1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有 。常用来可以标定所配X的溶液浓度是否准确的实验名称是 。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH) 3]。从试剂工业的角度,你认为方案 更合理,理由是 。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。
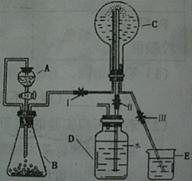
①仪器A的名称是 ,装置中A口部和B口部之间联通导气管的作用是 。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的 (填字母序号)。
a.生石灰 b.烧碱 c.胆矾 d.碱石灰
(4)室温下,在a mol·L -1的(NH 4) 2SO 4水溶液中pH=5,存在着平衡NH 4 ++H 2O  NH 3·H 2O+H +,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH 3·H 2O+H +,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
某研究性学习小组用不纯的氧化铝(杂质为Fe 2O 3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):

(1)试剂X的化学式为 ,反应Ⅰ的离子方程式是 。实验室配制480mL 1 mol·L -1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有 。常用来可以标定所配X的溶液浓度是否准确的实验名称是 。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH) 3]。从试剂工业的角度,你认为方案 更合理,理由是 。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。

①仪器A的名称是 ,装置中A口部和B口部之间联通导气管的作用是 。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的 (填字母序号)。
a.生石灰 b.烧碱 c.胆矾 d.碱石灰
(4)室温下,在a mol·L -1的(NH 4) 2SO 4水溶液中pH=5,存在着平衡NH 4 ++H 2O NH 3·H 2O+H +,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH 3·H 2O+H +,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。

(1)试剂X的化学式为 ,反应Ⅰ的离子方程式是 。实验室配制480mL 1 mol·L -1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有 。常用来可以标定所配X的溶液浓度是否准确的实验名称是 。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH) 3]。从试剂工业的角度,你认为方案 更合理,理由是 。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。

①仪器A的名称是 ,装置中A口部和B口部之间联通导气管的作用是 。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的 (填字母序号)。
a.生石灰 b.烧碱 c.胆矾 d.碱石灰
(4)室温下,在a mol·L -1的(NH 4) 2SO 4水溶液中pH=5,存在着平衡NH 4 ++H 2O
 NH 3·H 2O+H +,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH 3·H 2O+H +,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
参考答案:
