问题:
(18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。
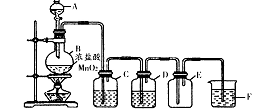
仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl 2与FeBr 2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol 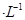 的溶液缓缓通入100 mLCl 2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl 2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl 2先将Fe 2 +氧化生成Fe 3 +,溶液逐渐变黄色,Cl 2再把Br -氧化成Br 2,溶液变为棕黄色。
假设2:Cl 2先将Br -氧化生成Br 2,溶液逐渐变黄色,Cl 2再把Fe 2 +氧化成Fe 3 +,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl 2、Fe 3 +、Br 2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr 2的溶液中通人0.1molCl 2充分反应,写出反应的离子方程式:________ 。
(18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。

仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl 2与FeBr 2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol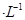 的溶液缓缓通入100 mLCl 2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl 2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl 2先将Fe 2 +氧化生成Fe 3 +,溶液逐渐变黄色,Cl 2再把Br -氧化成Br 2,溶液变为棕黄色。
假设2:Cl 2先将Br -氧化生成Br 2,溶液逐渐变黄色,Cl 2再把Fe 2 +氧化成Fe 3 +,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl 2、Fe 3 +、Br 2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr 2的溶液中通人0.1molCl 2充分反应,写出反应的离子方程式:________ 。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。

仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl 2与FeBr 2溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol
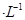 的溶液缓缓通入100 mLCl 2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl 2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2,溶液黄色加深,变为棕黄色。 【提出假设】上述现象发生的原因可能是:
假设1:Cl 2先将Fe 2 +氧化生成Fe 3 +,溶液逐渐变黄色,Cl 2再把Br -氧化成Br 2,溶液变为棕黄色。
假设2:Cl 2先将Br -氧化生成Br 2,溶液逐渐变黄色,Cl 2再把Fe 2 +氧化成Fe 3 +,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序

根据实验得出Cl 2、Fe 3 +、Br 2氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr 2的溶液中通人0.1molCl 2充分反应,写出反应的离子方程式:________ 。
参考答案:
