问题:
某化学实验小组为了验证SO 2和Cl 2的漂白性,设计了如下图所示的实验装置。请回答下列问题:
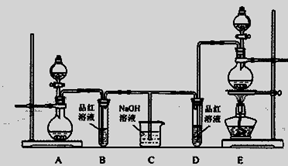
(1)他们制备SO 2和Cl 2所依据的原理分别是:Na 2SO 3+H 2SO 4=Na 2SO 4+H 2O+SO 2↑、MnO 2+4HCl(浓)  MnCl 2+Cl 2↑+2H 2O,则上图A、E装置中用来制Cl 2的装置是
MnCl 2+Cl 2↑+2H 2O,则上图A、E装置中用来制Cl 2的装置是
(填序号),反应中盐酸所表现的性质是 ;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是 ;
(3)装置C的作用是 ;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是 、 ;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为 。
某化学实验小组为了验证SO 2和Cl 2的漂白性,设计了如下图所示的实验装置。请回答下列问题:

(1)他们制备SO 2和Cl 2所依据的原理分别是:Na 2SO 3+H 2SO 4=Na 2SO 4+H 2O+SO 2↑、MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O,则上图A、E装置中用来制Cl 2的装置是
MnCl 2+Cl 2↑+2H 2O,则上图A、E装置中用来制Cl 2的装置是
(填序号),反应中盐酸所表现的性质是 ;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是 ;
(3)装置C的作用是 ;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是 、 ;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为 。

(1)他们制备SO 2和Cl 2所依据的原理分别是:Na 2SO 3+H 2SO 4=Na 2SO 4+H 2O+SO 2↑、MnO 2+4HCl(浓)
 MnCl 2+Cl 2↑+2H 2O,则上图A、E装置中用来制Cl 2的装置是
MnCl 2+Cl 2↑+2H 2O,则上图A、E装置中用来制Cl 2的装置是 (填序号),反应中盐酸所表现的性质是 ;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是 ;
(3)装置C的作用是 ;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是 、 ;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见酸,因而失去漂白作用。该反应的化学方程式为 。
参考答案:
