问题:
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO) 2、NaClO、NaClO 2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl 2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl 2与Na 2CO 3反应制取少量Cl 2O,配平并补充完整下列反应方程式:
______Cl 2+_______Na 2CO 3+________=_______NaHCO 3+____NaCl+____ Cl 2O
(3)黄色气体ClO 2可用于污水杀菌和饮用水净化。
①KClO 3与SO 2在强酸性溶液中反应可制得ClO 2,此反应的离子方程式为__________。
②ClO 2遇浓盐酸会生成Cl 2,每生成1mol Cl 2转移电子的物质的量为__________。
③ClO 2可将废水中的Mn 2 +转化为MnO 2而除去,本身还原为Cl -,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl 2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O 2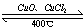 2Cl 2+2H 2O,可实现氯的循环利用。
2Cl 2+2H 2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
② 
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H 2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO) 2、NaClO、NaClO 2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl 2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl 2与Na 2CO 3反应制取少量Cl 2O,配平并补充完整下列反应方程式:
______Cl 2+_______Na 2CO 3+________=_______NaHCO 3+____NaCl+____ Cl 2O
(3)黄色气体ClO 2可用于污水杀菌和饮用水净化。
①KClO 3与SO 2在强酸性溶液中反应可制得ClO 2,此反应的离子方程式为__________。
②ClO 2遇浓盐酸会生成Cl 2,每生成1mol Cl 2转移电子的物质的量为__________。
③ClO 2可将废水中的Mn 2 +转化为MnO 2而除去,本身还原为Cl -,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl 2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O 2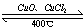 2Cl 2+2H 2O,可实现氯的循环利用。
2Cl 2+2H 2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H 2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
(1)Ca(ClO) 2、NaClO、NaClO 2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl 2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl 2与Na 2CO 3反应制取少量Cl 2O,配平并补充完整下列反应方程式:
______Cl 2+_______Na 2CO 3+________=_______NaHCO 3+____NaCl+____ Cl 2O
(3)黄色气体ClO 2可用于污水杀菌和饮用水净化。
①KClO 3与SO 2在强酸性溶液中反应可制得ClO 2,此反应的离子方程式为__________。
②ClO 2遇浓盐酸会生成Cl 2,每生成1mol Cl 2转移电子的物质的量为__________。
③ClO 2可将废水中的Mn 2 +转化为MnO 2而除去,本身还原为Cl -,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl 2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O 2
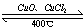 2Cl 2+2H 2O,可实现氯的循环利用。
2Cl 2+2H 2O,可实现氯的循环利用。 已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②

则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H 2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
参考答案:
