问题:
(20分)MnO 2是一种重要的功能无机材料,粗MnO 2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO 2(只含有较多的MnO和MnCO 3)样品转化为纯MnO 2的实验,其流程如下:
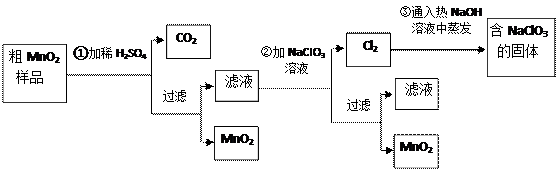
(1)第①步加稀H 2SO 4时,将粗MnO 2样品中 ▲ , ▲ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是(补充完整并配平): Mn 2++ ClO 3 —+ = MnO 2↓+ Cl 2↑+ ;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲  、 ▲ 、玻璃棒。
、 ▲ 、玻璃棒。
(4)若粗MnO 2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO 2,并收集到0.224LCO 2(标准状况下),则在第①步反应中至少需要 ▲ mol H 2SO 4。写出计算过程 (已知摩尔质量:MnO 2 -87g/mol; MnO-71g/mol; MnCO 3-115 g/mol)
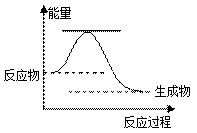
(5)已知2H 2O 2(l)=2H 2O(l)+O 2(g)△H=a kJ·mol -1反应过程的能量变化如图所示。则
①该反应为 ▲ 反应(填“吸热”或“放热”)。
②请用虚线在右图中画出使用MnO 2作催化剂的情况下反应过程中体系能量变化示意图。
(20分)MnO 2是一种重要的功能无机材料,粗MnO 2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO 2(只含有较多的MnO和MnCO 3)样品转化为纯MnO 2的实验,其流程如下:

(1)第①步加稀H 2SO 4时,将粗MnO 2样品中 ▲ , ▲ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是(补充完整并配平): Mn 2++ ClO 3 —+ = MnO 2↓+ Cl 2↑+ ;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲ 、 ▲ 、玻璃棒。
、 ▲ 、玻璃棒。
(4)若粗MnO 2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO 2,并收集到0.224LCO 2(标准状况下),则在第①步反应中至少需要 ▲ mol H 2SO 4。写出计算过程 (已知摩尔质量:MnO 2 -87g/mol; MnO-71g/mol; MnCO 3-115 g/mol)
(5)已知2H 2O 2(l)=2H 2O(l)+O 2(g)△H=a kJ·mol -1反应过程的能量变化如图所示。则
①该反应为 ▲ 反应(填“吸热”或“放热”)。
②请用虚线在右图中画出使用MnO 2作催化剂的情况下反应过程中体系能量变化示意图。


(1)第①步加稀H 2SO 4时,将粗MnO 2样品中 ▲ , ▲ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是(补充完整并配平): Mn 2++ ClO 3 —+ = MnO 2↓+ Cl 2↑+ ;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲
 、 ▲ 、玻璃棒。
、 ▲ 、玻璃棒。 (4)若粗MnO 2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO 2,并收集到0.224LCO 2(标准状况下),则在第①步反应中至少需要 ▲ mol H 2SO 4。写出计算过程 (已知摩尔质量:MnO 2 -87g/mol; MnO-71g/mol; MnCO 3-115 g/mol)
(5)已知2H 2O 2(l)=2H 2O(l)+O 2(g)△H=a kJ·mol -1反应过程的能量变化如图所示。则
①该反应为 ▲ 反应(填“吸热”或“放热”)。
②请用虚线在右图中画出使用MnO 2作催化剂的情况下反应过程中体系能量变化示意图。

|
参考答案:
