问题:
(16分)高铁酸钾(K 2FeO 4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO 4 2 -与水反应的方程式:4FeO 4 2 -+10H 2O  4Fe(OH) 3+8OH -+_____。
4Fe(OH) 3+8OH -+_____。
K 2FeO 4在处理水的过程中所起的作用是 和 。
(2)常温下,Fe(OH) 3 的K sp = 4.0×10 -38,请写出Fe(OH) 3在水中的溶解平衡方程式
(3)将适量K 2FeO 4配制成c(FeO 4 2 -) =1.0 mmol·L - 1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO 4 2 -)的变化,结果见图Ⅰ。第(1)题中的反应为FeO 4 2 -变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。
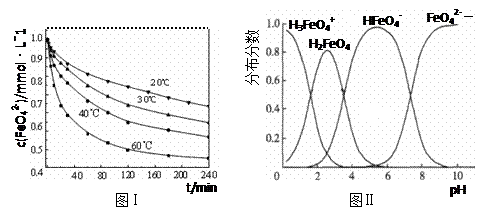
(4)FeO 4 2 -在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO 4 -的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H 2FeO 4+OH -=HFeO 4 -+H 2O
(16分)高铁酸钾(K 2FeO 4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO 4 2 -与水反应的方程式:4FeO 4 2 -+10H 2O 4Fe(OH) 3+8OH -+_____。
4Fe(OH) 3+8OH -+_____。
K 2FeO 4在处理水的过程中所起的作用是 和 。
(2)常温下,Fe(OH) 3 的K sp = 4.0×10 -38,请写出Fe(OH) 3在水中的溶解平衡方程式
(3)将适量K 2FeO 4配制成c(FeO 4 2 -) =1.0 mmol·L - 1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO 4 2 -)的变化,结果见图Ⅰ。第(1)题中的反应为FeO 4 2 -变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。

(4)FeO 4 2 -在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO 4 -的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H 2FeO 4+OH -=HFeO 4 -+H 2O
(1)请完成FeO 4 2 -与水反应的方程式:4FeO 4 2 -+10H 2O
 4Fe(OH) 3+8OH -+_____。
4Fe(OH) 3+8OH -+_____。 K 2FeO 4在处理水的过程中所起的作用是 和 。
(2)常温下,Fe(OH) 3 的K sp = 4.0×10 -38,请写出Fe(OH) 3在水中的溶解平衡方程式
(3)将适量K 2FeO 4配制成c(FeO 4 2 -) =1.0 mmol·L - 1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO 4 2 -)的变化,结果见图Ⅰ。第(1)题中的反应为FeO 4 2 -变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。

(4)FeO 4 2 -在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO 4 -的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H 2FeO 4+OH -=HFeO 4 -+H 2O
参考答案:
