问题:
【题文】(15分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO 2和3mol H 2,发生的反应为:CO 2(g)+3H 2(g) ?CH 3OH(g)+H 2O(g),△H=-a kJ·mol -1(a>0), 测得CO 2(g)和CH 3OH(g)的浓度随时间变化如图所示。
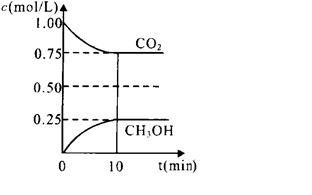
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO 2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H 2,同时生成0.4molH 2O
D.该体系中H 2O与CH 3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
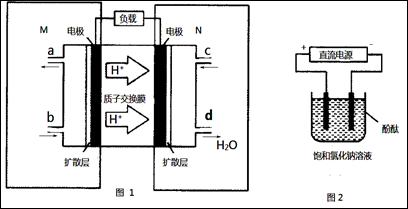
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO 2生产甲醇燃料的方法:
已知:CO 2(g)+3H 2(g) ? CH 3OH(g)+H 2O(g) △H=-a kJ·mol -1;
CH 3OH(g)=CH 3OH(l) △H=-b kJ·mol -1;
2H 2(g)+O 2(g)=2H 2O(g) △H=-c kJ·mol -1;
H 2O(g)=H 2O(l) △H=-d kJ·mol -1,
则表示CH 3OH(l)燃烧热的热化学方程式为:_____________________________
【题文】(15分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO 2和3mol H 2,发生的反应为:CO 2(g)+3H 2(g) ?CH 3OH(g)+H 2O(g),△H=-a kJ·mol -1(a>0), 测得CO 2(g)和CH 3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是________。(选填编号)
A.CO 2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H 2,同时生成0.4molH 2O
D.该体系中H 2O与CH 3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO 2生产甲醇燃料的方法:
已知:CO 2(g)+3H 2(g) ? CH 3OH(g)+H 2O(g) △H=-a kJ·mol -1;
CH 3OH(g)=CH 3OH(l) △H=-b kJ·mol -1;
2H 2(g)+O 2(g)=2H 2O(g) △H=-c kJ·mol -1;
H 2O(g)=H 2O(l) △H=-d kJ·mol -1,
则表示CH 3OH(l)燃烧热的热化学方程式为:_____________________________
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO 2和3mol H 2,发生的反应为:CO 2(g)+3H 2(g) ?CH 3OH(g)+H 2O(g),△H=-a kJ·mol -1(a>0), 测得CO 2(g)和CH 3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是________。(选填编号)
A.CO 2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H 2,同时生成0.4molH 2O
D.该体系中H 2O与CH 3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO 2生产甲醇燃料的方法:
已知:CO 2(g)+3H 2(g) ? CH 3OH(g)+H 2O(g) △H=-a kJ·mol -1;
CH 3OH(g)=CH 3OH(l) △H=-b kJ·mol -1;
2H 2(g)+O 2(g)=2H 2O(g) △H=-c kJ·mol -1;
H 2O(g)=H 2O(l) △H=-d kJ·mol -1,
则表示CH 3OH(l)燃烧热的热化学方程式为:_____________________________
参考答案:
