问题:
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
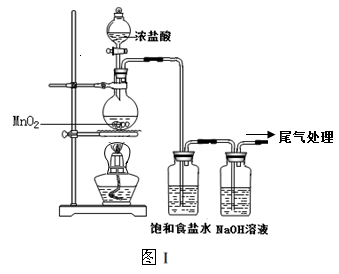
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
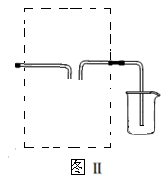
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl 2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H 2O(l)H 1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO 3(aq)H 2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na 2SO 3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na 2SO 3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na 2SO 3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na 2SO 3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。


实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl 2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H 2O(l)H 1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO 3(aq)H 2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na 2SO 3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na 2SO 3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na 2SO 3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na 2SO 3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。


实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl 2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H 2O(l)H 1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO 3(aq)H 2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na 2SO 3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na 2SO 3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na 2SO 3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na 2SO 3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
参考答案:
